Minyak Atsiri dan Soal-soal
MINYAK ATSIRI
Oleh : Erwinsyah Utama, Minat Karya Nita Hia, Rahayu, Rini F. Hutabarat, Sonnya Amalya
Oleh : Erwinsyah Utama, Minat Karya Nita Hia, Rahayu, Rini F. Hutabarat, Sonnya Amalya
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Negeri Medan
Editor : Erwinsyah Utama
a.
Capaian
Pembelajaran
- Menguasai materi kajian konsep dan deskripsi materi kuliah Kimia Organik Bahan Alam secara menyeluruh dan berkarakter.
- Menguasai materi kajian konsep tentang minyak atsiri, sumber-sumber minyak atsiri dari literatur dan dari berbagai tumbuhan di alam sekitar, sifat, kegunaan, dan reaksi- reaksi minyak atsiri.
- Terampil mengisolasi, mengidentifikasi, mengkarakterisasi, dan memurnikan senyawa kelompok minyak atsiri dari sumber bahan alam
b.
Indikator
Capaian Pembelajaran
- Mahasiswa komitmen mengikuti perkuliahan Kimia Organik Bahan Alam.
- Mahasiswa menunjukkan karakter yang santun, kerja sama, disiplin, komunikatif, teliti, saling menghargai, kerja keras, dan tekun mempelajari materi Kimia Organik Bahan Alam.
- Komunikatif, terampil dan jelas mengkomunikasikan penjelasan materi tentang minyak atsiri, tatanama, sumber-sumber, sifat, kegunaan minyak atsiri dari berbagai tumbuhan di alam sekitar, dan reaksi- reaksi minyak atsiri.
- Terampil, kreatif dan memiliki karakter ketelitian dalam mengisolasi, mengidentifikasi, mengkarakterisasi, dan memurnikan senyawa minyak atsiri dari sumber bahan alam sekitar.
c.
Bahan
Kajian
Pada kajian pokok
bahasan tentang minyak atsiri, maka kreativitas dan karakter berfikir mahasiswa
diarahkan pada pembahasan tentang sumber minyak atsiri,
penyulingan minyak atsiri, transformasi minyak atsiri, sifat fisika dan kimia minyak atsiri, reaksi-reaksi, isolasi, identifikasi , karakterisasi, dan kegunaan minyak atsiri.
1. MINYAK ATSIRI
Minyak atsiri merupakan senyawa metabolit sekunder
yang termasuk dalam golongan terpenoid yang disintesis melalui jalur asam
mevalonat (Ganjewala, 2009). Minyak atsiri memberikan aroma tertentu dan khas
pada tumbuhan (Muchtaridi, 2015). Minyak atsiri dihasilkan dari bagian jaringan
tanaman tertentu seperti akar, batang, kulit, daun, bunga, buah, atau biji
(Lutony dan Yeyet, 2002). Tumbuhan penghasil minyak atsiri antara lain termasuk
family Pinaceae, Labiatae, Compositae, Myrtaceae, Rutaceae, Piperaceae dan
Zingiberaceae. Minyak atsiri terdapat pada setiap bagian tumbuhan yaitu
daun, bunga, biji, batang, kulit, dan akar.
Minyak ini disebut juga minyak menguap, minyak eteris,
minyak esensial karena pada suhu kamar mudah menguap. Dalam keadaan segar dan
murni, minyak atsiri umumnya tidak berwarna, namun pada penyimpanan yang lama
minyak atsiri dapat teroksidasi. Untuk mencegah oksidasi, minyak atsiri harus
disimpan dalam bejana gelas yang berwarna gelap, diisi penuh, ditutup rapat,
serta disimpan di tempat yang kering dan sejuk (Ketaren, 1986).
Minyak atsiri merupakan
cairan tidak berwarna yang bersifat volatil, memiliki bau yang khas, indeks
bias yang tinggi, serta bersifat optis aktif. Minyak atsiri larut dalam
alkohol, kloroform, eter, aseton, karbon disulfida dan tidak larut dalam air.
Variasi struktural dalam golongan ini memiliki sifat yang sama seperti
monoterpenoid dengan alkohol hidrokarbon dan keton menjadi yang paling penting.
Contohnya seperti ß-
bisabolene, longifoline, farnesol, santalol, sinesals, cedryl acetat.
Tanaman yang
menghasilkan minyak atsiri tidak terbatas pada satu kelompok taksonomi tertentu
tetapi didistribusikan ke semua kelas tanaman. Gimnospermae contohnya famili
cupressaceae (kayu cedar, daun cedar, minyak juniper, dan lain-lain) dan
pinaceae (minyak pinus, dan lain-lain), serta angiospermae diantaranya
magnoliopsida, rosopsida, dan liliopsida. Famili dikotil yang paling penting
adalah Apiaceae (adas, ketumbar,dan lain-lain), Asteraceae atau Compositae
(chamomile, apsintus, minyak taragon, dan lain-lain), Geraniceae (minyak geranium),
Illiciaceae (minyak adas bintang), Lamiaceae (mint, nilam, lavender, oregano,
dan lain-lain), Lauraceae (kamper, cinnamon, minyak sassafras, dan lain-lain),
Myristicaceae (pala), Myrtaceae (cengkeh), Oleaceae (minyak melati), Rosaceae
(minyak mawar), dan Santalaceae (minyak cendana). Dalam monokotil (Liliopsida),
secara substansi terbatas pada Acoraceae (calamus), Poaceae (Vetiver), dan
Zingiberaceae (jahe dan kapulaga) (Baser
dan Buchbauer, 2010).
Salah satu minyak atsiri yang diproduksi di
Indonesia adalah berasal dari sereh wangi (Cymbopogon winterianus)
yang diperoleh melalui teknik penyulingan. Minyak atsiri ini dibuat dari daun
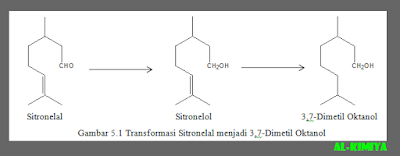
dan batang dengan komponen utama hasil isolasi berupa sitronelal, sitronelol dan
geraniol. Sitronelal merupakan senyawa yang memiliki rumus molekul C10H20O
(3,7-dimetil-6 okten-1-ol). Sitronelal memiliki massa relatif 154,25 g/mol dan dapat
direduksi menjadi sitronelol. Dalam reaksi siklisasi dan suasana asam,
sitronelal dapat menghasilkan isopulegol dan saat polimerisasi menggunakan basa
juga menghasilkan isopulegol (Pybus dkk., 1999).
Menurut Wijesekera (1973), sitronelal,
sitronelol dan geraniol dapat diubah menjadi turunan-turunannya yang digunakan
secara luas dalam industri parfum. Minyak sereh dapat ditingkatkan nilai ekonominya
dengan cara mengkonversi komponen utamanya yaitu
sitronelal menjadi turunannya.
Selain sereh wangi, biji kapulaga juga mengandung
minyak atsiri. Kandungan minyak atsiri dari biji kapulaga (Amomum cardamomum)
adalah sebesar 3-7% yang terdiri atas sineol, borneol, dan terpineol
(Agoes,2010). Minyak atsiri biji kapulaga berwara kuning muda jernih, rendemen
1,08%, berat jenis 0,9020 g/mL pada suhu 25oC, indeks bias 1,4690
pada 20oC. Komponen minyak atsiri biji kapulaga adalah α-pinena,
ß-pinena, p-simena, 1,8-sineol dan α-terpineol (Fachriyah dan Sumardi, 2007).
2. PENYULINGAN MINYAK ATSIRI
2.1 Penyulingan dengan air dan penyulingan dengan uap disertai dengan
pengurangan tekanan
Pengurangan tekanan akan memperpendek
waktu penyulingan pada tekanan 1 atmosfir. Keuntungan utama dengan cara ini
ialah minyak atsiri yang diperoleh berbau sama dengan bau aslinya, karena penyulingan
dilakukan pada suhu kurang dari 70oC (biasanya pada suhu 50oC)
hingga penguraian karena suhu tinggi dapat dihindari. Kelemahannya, alat yang dibutuhkan mahal.
2.2 Penyulingan dengan air dan penyulingan dengan uap disertai penaikkan
tekanan
Penyulingan dengan uap dengan menaikkan
tekanan, baik dilakukan untuk simplisia yang keras sepeti kayu, biji, kulit
kayu. Dengan penyulingan ini akan
diperoleh minyak lebih banyak dan akan memperpendek waktu penyulingan. Kerugian degnan penyulingan ini ialah terjadi
peruraian minyak atisiri sehingga berbeda dengan bentuk aslinya dan diperoleh
lebih sedikit dibanding dengan cara lain.
Tanaman yang mengandung minyak atisiri
bertitik didih rendah, lebih baik disuling dengan tekanan kurang dari 1
atmosfir sedangkan yang mengandung minyak bertitik didih tinggi dapat dengan
penyulingan uap bertekanan lebih tinggi dari 1 atmosfir.Dalam metode
penyulingan uap langsung (direct steam destillation) yang dapat dipakai pada
obat-obatan tanaman segar (peppermint, spearmint), hasilnya dipotong dan
ditempatkan secara langsung ke dalam tangki penyuling logam pada truck
bed. Truck ini digerakkan pada shed
penyuling dimana steam lines ditempelkan pada bagian bawah tangki penyuling. Cara ini digunakan untuk daun dan mengandung
kadar minyak yang tinggi sehingga tidak perlu maserasi. Uap ditekan melalui pipa dan membawa tetesan
minyak melalui pipa yang akhirnya melewati ruang pengembun. Selama penyulingan
uap, komponen tertentu minyak atsiri dapat terhidrolisis, sementara unsur lainnya dapat terdekomposisi
dengan suhu udara tinggi. Metode
penyulingan ideal yang menggunakan uap harus memberikan tingkat difusi setinggi
mungkin dari uap dan air melalui membran tanaman sehingga hidrolisis dan
dekomposisi tetap minimal (Ketaren, 1986).
3. ISOLASI MINYAK ATSIRI
3.1. Destilasi
Pembuatan
minyak atsiri dengan penyulingan dipengaruhi oleh 3 faktor, yaitu: besarnya
tekanan uap yang digunakan, bobot molekul masing-masing komponen dalam minyak,
dan kecepatan keluarnya minyak atsiri dari simplisia. Namun demikian, pembuatan minyak atisiri
dengan cara penyulingan mempunyai beberapa kelemahan:
- Tidak baik terhadap beberapa jenis minyak yang mengalami kerusakan oleh adanya panas dan air.
- Minyak atisiri yang mengandung fraksi ester akan terhidrolisis karena adanya air dan panas.
- Komponen minyak yang larut dalam air tidak dapat tersuling.
- Komponen minyak yang bertitik didih tinggi yang menentukan bau wangi dan mempunyai daya ikat terhadap bau, sebgaian tidak ikut tersuling dan tetap tertinggal dalam bahan.
3.1.a Destilasi
air
Pada destilasi air terjadi kontak
langsung antara simplisia dengan air mendidih. Simplisia yang telah
dipotong-potong, digiling kasar, atau digerus halus dididihkan dengan air, uap
air dialirkan melalui pendingin, sulingan berupa minyak yang belum murni
ditampung. Penyulingan dengan cara ini
sesuai untuk simplisia kering yang tidak rusak dengan pendidihan. Penyulingan air biasa digunakan untuk menyari minyak atsiri yang
tahan panas dari grabahan maupun bahan yang berkayu dan keras.
Keuntungan metode ini adalah kualitas
minyak atsiri baik (jika diperhatikan suhu tidak terlalu tinggi), alat
sederhana dan mudah diperoleh, dan mudah pengerjaannya. Kerugian dari metode
ini adalah: tidak semua bahan dapat dilakukan dengan cara
ini (terutama bahan yang mengandung sabun, bahan yang larut dalam air, dan
bahan yang mudah hangus), adanya air sering menyebabkan terjadinya hidrolisis,
dan waktu penyulingan yang lama.
3.1.b Destilasi
uap dan air
Penyulingan dengan cara ini memakai
alat semacam dandang. Simplisia
diletakkan di atas bagian yang berlubang-lubang sedangkan air di lapisan bawah.
Uap dialirkan melalui pendingin dan sulingan ditampung, minyak yang diperoleh
belum murni. Cara ini baik untuk simplisia basah atau kering yang rusak pada
pendidihan. Untuk simplisia basah atau kering yang rusak pada pendidihan. Untuk
simplisia kering harus dimaserasi lebih dulu, sedangkan untuk simplisia segar
yang baru dipetik tidak perlu dimaserasi. Cara penyulingan ini banyak dilakukan
sebagai industri rumah, karena peralatan mudah didapat dan hasil yang diperoleh
cukup baik.
Kerugian cara ini, hanya minyak dengan
titik didih lebih rendah dari air yang dapat tersuling sehingga hasil
penyulingan tidak sempurna (masih banyak minyak yang tertinggal di ampas).
3.1.c Destilasi
uap.
Minyak atsiri biasanya didapatkan
dengan penyulingan uap pada bagian tanaman yang mengandung minyak. Metode
penyulingan ini tergantung pada kondisi bahan tanaman. Penyulingan
dengan uap memerlukan air, uap panas yang biasanya bertekanan lebih dari 1
atmosfer dialirkan melalui suatu pipa uap.
Peralatan yang dipakai tidak berbeda dnegn penyulingan air dan uap,
hanya diperlukan alat tambahan untuk memeriksa suhu dan tekanan. Bila pemeriksaan telah dilakukan degnan air
dan uap, hanya diperlukan alat tambahan untuk memeriksa suhu dan tekanan. Bila
pemeriksaan telah dilakukan dengan baik, dengan cara ini akan diperoleh minyak
yang lebih banyak. Cara ini bisa juga digunakan untuk membuat minyak atisiri
dari biji, akar, kayu, yang umumnya mengandugn komponen minyak yang bertitik
didih tinggi. Penyulingan ini dapat digunakan utnuk membuat minyak cengkeh,
minyak kayumanis, minyak akar wangi, minyak sereh, minyak kayuputih, dll.
Keuntungan dari cara ini adalah: kualitas minyak yang dihasilkan cukup baik, tekanan dan suhu
dapat diatur, waktu penyulingan pendek, hidrolisis tidak terjadi. Kerugian metode
ini yaitu: peralatan yang mahal dan memerlukan tenaga ahli.
3.2 Ekstraksi dengan pelarut minyak atsiri
Prinsip
dari ekstraksi ini adalah melarutkan minyak atisiri yang terdapat dalam
simplisia dengan pelarut organik yang mudah menguap. Simplisia diekstraksi
dengan plarut yang cocok dalam suatu ekstraktor pada suhu kamar, kemudian
pelarut diuapkan dengan tekanan yang dikurangi. Dengan cara ini diperlukan
banyak pelarut sehingga biaya cukup mahal dan harus dilakukan oleh tenaga ahli.
Sebagai pelarut biasanya dipakai eter minyak tanah. Pelarut yang
baik harus memenuhi persyaratan sebagai berikut:
- Melarutkan sempurna komponen dari minyak atsiri yang terdapat dalam tanaman.
- Mempunuyai titik didih rendah.
- Tidak campur dengan air.
- Inert, tidak bereaksi dengan komponen minyak atsiri.
- Mempunyai satu titik didih, bila diuapkan tidk meninggalkan sisa.
- Harga murah.
- Bila mungkin tidak mudah terbakar.
Pelarut
yang paling banyak digunakan adalah eter minyak tanah. Alkohol tidak baik
digunakan karena alkohol melarutkan air yang terdapat dalam tanaman. Untuk
simplisia tertentu alkohol menghasilkan bau yang tidak enak. Alkohol baik
digunakan untuk simplisia kering. Sari
yang diperoleh dikenal dengan nama tingtur yang banyak digunakan untuk sediaan
farmasi. Ekstraksi dengan pelarut mudah
menguap, banyak banyak digunakan di berbagai negara dan secara umum dapat dipakai
untuk sediaan farmasi. Ekstraksi dengan pelarut mudah menguap, banyak digunakan
di berbagai negara dan secara umum dapat dipakai untuk bermacam simplisia dan diperoleh minyak
atsiri sesuai dengan aslinya.
Ekstraksi dengan pelarut organik
umumnya digunakan untuk mengekstraksi minyak atsiri yang mudah rusak oleh
pemanasan dengan uap dan air. Cara ini baik untuk mengekstraksi minyak dari
bunga-bungaan, misal: bunga cempaka, melati, mawar, dll.
Cara kerja ekstraksi dengan pelarut menguap cukup sederhana, yaitu dengan cara memasukkan bahan yang akan diekstraksi ke dalam ketel ekstraktor khusus dan kemudian ekstraksi berlangsung secara sistematik pada suhu kamar, dengan menggunakan petroleum eter sebagai pelarut. Pelarut akan berpenetrasi ke dalam bahan dan melarutkan minyak bunga beserta beberapa jenis lilin dan albumin serta zat warna. Larutan tersebut selanjutnya dipompa ke dalam evaporator dan minyak dipekatkan pada suhu rendah. Setelah semua pelarut diuapkan dalam keadan vakum, maka diperoleh minyak bunga yang pekat. Suhu harus tetap dijaga tidak terlalu tinggi selama proses ini. Dengan demikian uap aktif yang terbentuk tidak akan merusak persenyawan minyak bunga. Jika dibandingkan dengan mutu minyak bunga hasil penyulingan, maka minyak bunga hasil ekstraksi menggunakan pelarut lebih mendekati bau bunga alamiah. Semua minyak yang diekstraksi dengan pelarut menguap mempunyai warna gelap, karena mengandung pigmen alamiah yang bersifat tidak dapat menguap. Sebaliknya hasil penyulingan uap, umumnya berwarna cerah dan bersifat larut dalam alkohol 95%.
Cara kerja ekstraksi dengan pelarut menguap cukup sederhana, yaitu dengan cara memasukkan bahan yang akan diekstraksi ke dalam ketel ekstraktor khusus dan kemudian ekstraksi berlangsung secara sistematik pada suhu kamar, dengan menggunakan petroleum eter sebagai pelarut. Pelarut akan berpenetrasi ke dalam bahan dan melarutkan minyak bunga beserta beberapa jenis lilin dan albumin serta zat warna. Larutan tersebut selanjutnya dipompa ke dalam evaporator dan minyak dipekatkan pada suhu rendah. Setelah semua pelarut diuapkan dalam keadan vakum, maka diperoleh minyak bunga yang pekat. Suhu harus tetap dijaga tidak terlalu tinggi selama proses ini. Dengan demikian uap aktif yang terbentuk tidak akan merusak persenyawan minyak bunga. Jika dibandingkan dengan mutu minyak bunga hasil penyulingan, maka minyak bunga hasil ekstraksi menggunakan pelarut lebih mendekati bau bunga alamiah. Semua minyak yang diekstraksi dengan pelarut menguap mempunyai warna gelap, karena mengandung pigmen alamiah yang bersifat tidak dapat menguap. Sebaliknya hasil penyulingan uap, umumnya berwarna cerah dan bersifat larut dalam alkohol 95%.
Dalam industri parfum, sebagian besar
produksi minyak atsiri modern dilakukan dengan ekstraksi, dengan menggunakan
sistem pelarut yang berdasar pelarut yang mudah menguap seperti eter minyak
tanah. Keuntungan utama ekstraksi adalah suhu yang bisa dipertahankan kurang
lebih 50oC selama proses. Hasilnya minyak atsiri yang didapat mempunyai
bau yang lebih alami yang tidak dapat ditandingi minyak suling. Hal ini karena
selama penyulingan, dengan suhu yang tinggi, dapat mengubah konstituen minyak
atsiri. Namun demikian, metode penyulingan operasionalnya lebih murah
dibandingkan dengan proses ekstraksi.
Simplisia dimasukkan ke dalam ekstraktor dan selanjutnya pelarut oraganik murni dipompakan ke dalam ekstraktor. Pelarut organik akan menembus ke dalam ekstraktor. Pelarut organik akan menembus ke dalam jaringan simplisia dan akan melarutkan minyak serta bahan lainnya seperti dmar dan lilin. Komponen tersebut merupakan pengotor, dan dipisahkan dengan cara penyulingan pada suhu rendah dan tekanan rendah. Dengan cara penyulingan ini diperoleh campuran pelarut dan minyak atsiri disebut concrete.
Simplisia dimasukkan ke dalam ekstraktor dan selanjutnya pelarut oraganik murni dipompakan ke dalam ekstraktor. Pelarut organik akan menembus ke dalam ekstraktor. Pelarut organik akan menembus ke dalam jaringan simplisia dan akan melarutkan minyak serta bahan lainnya seperti dmar dan lilin. Komponen tersebut merupakan pengotor, dan dipisahkan dengan cara penyulingan pada suhu rendah dan tekanan rendah. Dengan cara penyulingan ini diperoleh campuran pelarut dan minyak atsiri disebut concrete.
Pemurnian
concrete (pelarut + minyak atsiri)
ini dilakukan dengan melarutkan dalam alcohol,
diambil fase alcohol. Fase alcohol ini didinginkan 0oC, diperoleh
minyak atsiri dalam alcohol dan lilin. Dilakukan penyaringan terhadap campuran
ini, diambil fase minyak atsiri dalam alkohol. Untuk memisahkan alkohol dan
minyak atsiri, dilakukan penyulingan pada tekanan dan suhu rendah, akan
diperoleh alkohol dan minyak atsiri murni (Lutony,T dan yeyet 2002).
4. IDENTIFIKASI MINYAK ATSIRI
Identifikasi keberadaan minyak atsiri secara umum dapat
dilakukan dengan cara sebagai berikut:
1. Teteskan satu tetes minyak atsiri
pada permukaan air, maka minyak atsiri akan menyebar dan air tidak akan menjadi
keruh. Bandingkan dengan minyak lemak.
2. Teteskan satu tetes minyak atsiri
pada sepotong kertas saring. Bila dibiarkan, maka minyak atsiri akan menguap
dengan sempurna tanpa meninggalkan noda transparan. Bandingkan dengan minyak
lemak.
3. Kocoklah 1 ml minyak atsiri dengan 1
ml larutan natrium klorida jenuh dalam tabung reaksi, biarkan memisah kembali.
Volume lapisan air tidak boleh bertambah.
4. Ukurlah kelarutan minyak atsiri
dalam etanol, petroleum eter, dan kloroform. Hitung beberapa tetes pelarut yang
diperlukan untuk melarutkan dengan sempurna satu tetes minyak atsiri.
5. Deteksi adanya senyawa fenol dalam
minya atsiri. Cara : ke dalam 2 ml larutan minyak atsiri (25% dalam etanol 95%
netral) tambahkan setetes larutan Ferri klorida. Amati warna yang terjadi.
6. Deteksi terjadinya reduksi volume
minyak atsiri yang mengandung fenol dan turunannya. Cara : ke dalam 2 ml minyak
atsiri, tambahkan larutan Natrium hidroksida. Kocok pelan-pelan dan amati
apakah terjadi reduksi volume (Pratama, dkk., 2016).
5. KARAKTERISASI MINYAK ATSIRI
5.1.
Teknik
Pemisahan dengan Cara Kromatografi
Selama setengah
abad terakhir, sejumlah besar teknik telah dikembangkan dan diterapkan untuk analisis
minyak esensial. Sebagian dari mereka telah diganti sekarang dengan lebih
efektif
atau teknik
yang lebih mudah ditangani, sementara metode lain mempertahankan signifikansi
mereka dan telah
diperbaiki
secara permanen. Sebelum masuk ke detail, fasilitas analitis di tahun enam
puluhan yang terakhir
abad harus
dianggap singkat. Metode yang tersedia untuk analisis minyak esensial pernah pada
waktu itu (Tabel 2.1) kromatografi lapis tipis (KLT), berbagai jenis
kromatografi kolom cair
(LC), dan sudah
liquid liquid chromatography (GC). Selain itu, beberapa spektroskopiteknik
seperti spektroskopi UV dan IR, MS, dan spektroskopi 1H-NMR telah tersedia.
Pada tahun-tahun berikutnya, beberapa teknik tambahan
dikembangkan dan diterapkan pada minyak esensial
analisis, termasuk: kromatografi cair kinerja tinggi
(HPLC); berbagai jenis arus balik kromatografi (CCC); superchritical fluid chromatography
(SFC); termasuk multidimensional teknik penggandengan, C-13 NMR, inframerah dekat (NIR),
dan spektroskopi Raman; dan banyak orang dari apa yang disebut teknik ditulis dgn tanda
penghubung, yang berarti kopling-on-line pemisahan kromatografi
perangkat untuk spektrometer, menghasilkan informasi
struktural yang berharga dari individu yang terpisah
komponen membuat identifikasinya layak.
5.1.a. Kromatografi Lapis Tipis
TLC adalah salah satu teknik kromatografi pertama dan telah digunakan selama bertahun-tahun untuk analisis minyak esensial. Metode ini memberikan informasi yang berharga dibandingkan dengan pengukuran sederhana nilai kimia dan fisik dan oleh karena itu telah diadopsi sebagai metode laboratorium standar untuk karakterisasi minyak esensial dalam berbagai farmakope. Dasar-dasar KLT telah dijelaskan oleh (Geiss 1987) dan dalam buku pegangan komprehensif oleh Stahl (1969), di mana banyak aplikasi dan contoh pada investigasi metabolit tumbuhan sekunder termasuk minyak esensial diberikan. Baru-baru ini, edisi ketiga dari buku pegangan TLC dari Shema dan Fried (2003) muncul. Pendekatan lebih lanjut di TLC telah mengembangkan TLC berkinerja tinggi (Kaiser, 1976), dan penerapan teknik aliran paksa seperti kromatografi lapisan berlebih (OPLC) dan rotasi planar chromatography (RPC) dijelaskan oleh Tyihák dan Nyiredy.
Terlepas dari kesederhanaan dan kecepatannya yang tak terbantahkan, teknik ini sekarang sudah usang untuk dianalisis campuran kompleks seperti minyak esensial, karena resolusinya yang rendah. Namun, untuk yang cepat penyelidikan pola minyak esensial dari ras kimia atau diferensiasi tanaman individu spesies, metode ini masih dapat berhasil diterapkan Sebagai tambahan,perak nitrat dan perak diresapi lapisan perkemburan telah digunakan untuk pemisahan olefi nicsenyawa, terutama hidrokarbon sesquiterpene dan baru-baru ini untuk isolasi sesquiterpenes individu (Saritas, 2000).
5.1.c Kromatografi Kolom Cair
5.1.b Kromatografi Gas
Namun, kemampuan pemisahan GC melebihi semua teknik pemisahan lainnya, meskipun hanya itu saja kolom dikemas telah digunakan. Evolusi yang keluar dari teknik ini di masa lalu bisa sangat mengesankan ditunjukkan dengan empat contoh pemisahan kromatografi gas dari minyak atsiri dari rue tanaman obat dan aromatik. Minyak ini dipisahkan oleh S. Bruno di menjadi delapan konstituen dan mewakili salah satu analisis kromatografi gas pertama dari itu Minyak esensial. Hanya beberapa tahun kemudian pada tahun 1964 pemisahan minyak yang sama telah diperbaiki dengan menggunakan Kromatografi gas Perkin Elmer (PE) dilengkapi dengan kolom pengemasan 2 m dan konduktivitas termaldetektor (TCD) dioperasikan di bawah kondisi isotermal yang menghasilkan 20 konstituen yang terpisah. Peningkatan lebih lanjut dari pemisahan minyak rue diperoleh setelah pengenalan suhu pemrograman dari oven kolom, menghasilkan sekitar 80 konstituen. Tanda terakhir perbaikan tidak dapat dilakukan adalah hasil dari pengembangan kolom kapiler resolusi tinggi dan detektor ionisasi ion sensitif (FID) sensitif. Dengan menggunakan kapiler kaca 50 m dengan 0,25 mm I.D., yang Minyak rue dapat dipisahkan menjadi sekitar 150 konstituen, pada tahun 1981. Namun, masalahnya terkait dengan kerapuhan kapiler kaca dan instalasi yang rumit mengurangi pengakuan jenis kolom ini, terlepas dari kualitasnya yang luar biasa. Ini telah berubah sejak kapiler silika leburan yang dapat dilepas menjadi tersedia secara komersial, yang hampir tidak bisa dipecahkan penggunaan normal. Selain itu, dengan teknologi pengaitan silang yang berbeda, masalah yang terkait dengan pelapisan dinding, terutama dengan fase polar, telah diatasi, sehingga semua jenis penting fasa diam yang digunakan dalam GC konvensional telah tersedia secara komersial. Yang paling sering digunakan fase diam untuk analisis minyak esensial telah, dan masih hari ini, fase kutub Carbowax 20M (DB-Wax, Supelcowax-10, HP-20M, Innowax, dll.), 14% cyanopropylphenyl – 86% metil polysiloxane (DB-1701, SPB-1701, HP-1701, OV-1701, dll.), dan fase nonpolar PDMS (DB-1, SPB-1, HP-1 dan HP-1ms, CPSil-5 CB, OV-1, dll.), Dan 5% phenyl methyl polysiloxane (DB-5, SPB-5, HP-5, CPSil-8 CB, OV-5, SE-54, dll.). Selain diameter kolom yang berbeda 0,53, 0,32, 0,25, 0,10, dan 0,05 mm, berbagai ketebalan akhir dapat dibeli. Meningkatkan kolom diameter dan ketebalan fasa diam fase meningkatkan kapasitas sampel dengan mengorbankan pemisahan efisiensi. Namun, kapasitas sampel menjadi penting, terutama dalam analisis jejak dan dengan beberapa teknik ditulis dgn tanda penghubung seperti kromatografi gas-Fourier transform infrared (GC-FTIR), di mana kapasitas sampel yang lebih tinggi diperlukan bila dibandingkan dengan GC-MS. Di sisi lain, itu penerapan kolom bore sempit dengan 100 μm I.D. dan lapisan tipis 0,2 μm telah ditunjukkan menjadi sangat efisien dan jumlah pelat teoritis sekitar 250.000 diterima kapiler 25 m (Lancas et al., 1988). Detektor paling umum di GC adalah FID karena sifatnya sensitivitas tinggi terhadap senyawa organik. TCD yang berlaku universal saat ini hanya digunakan untuk deteksi gas-fed karena sensitivitasnya yang sangat rendah dibandingkan dengan FID, dan tidak dapat digunakan GC kapiler. Senyawa yang mengandung nitrogen dapat secara selektif dideteksi dengan bantuan selektif Nitrogen-fosfor detector (NPD), dan senyawa terklorinasi oleh selektif dan sangat detektor penangkap elektron sensitif (ECD), yang sering digunakan dalam analisis pestisida. Senyawa yang mengandung oksigen telah secara selektif dideteksi dengan alat analisa O-FID khusus bahkan di dalamnya sampel yang sangat kompleks, yang terutama digunakan untuk analisis senyawa beroksigen di bensin, digunakan sebagai agen pencampur bahan bakar (Schneider et al., 1982). Selektivitas oksigen dari FID diperoleh dengan dua reaksi postcolumn on-line: Pertama reaksi retak membentuk karbon monoksida, yang berkurang dalam reaktor kedua menghasilkan jumlah metana yang sama, yang bisa sensitif dideteksi oleh FID. Karena secara total setiap atom oksigen diubah menjadi satu molekul metana, respon FID sebanding dengan jumlah oksigen dalam molekul masing-masing. Aplikasi dari O-FID untuk analisis minyak esensial telah disajikan. Namun, GC konvensional menggunakan kapiler silika terfusi dengan fase stasioner yang berbeda, termasuk kiral fase, dan FID sensitif, hingga kini teknik utama untuk analisis minyak esensial.
Namun, kemampuan pemisahan GC melebihi semua teknik pemisahan lainnya, meskipun hanya itu saja kolom dikemas telah digunakan. Evolusi yang keluar dari teknik ini di masa lalu bisa sangat mengesankan ditunjukkan dengan empat contoh pemisahan kromatografi gas dari minyak atsiri dari rue tanaman obat dan aromatik. Minyak ini dipisahkan oleh S. Bruno di menjadi delapan konstituen dan mewakili salah satu analisis kromatografi gas pertama dari itu Minyak esensial. Hanya beberapa tahun kemudian pada tahun 1964 pemisahan minyak yang sama telah diperbaiki dengan menggunakan Kromatografi gas Perkin Elmer (PE) dilengkapi dengan kolom pengemasan 2 m dan konduktivitas termaldetektor (TCD) dioperasikan di bawah kondisi isotermal yang menghasilkan 20 konstituen yang terpisah. Peningkatan lebih lanjut dari pemisahan minyak rue diperoleh setelah pengenalan suhu pemrograman dari oven kolom, menghasilkan sekitar 80 konstituen. Tanda terakhir perbaikan tidak dapat dilakukan adalah hasil dari pengembangan kolom kapiler resolusi tinggi dan detektor ionisasi ion sensitif (FID) sensitif. Dengan menggunakan kapiler kaca 50 m dengan 0,25 mm I.D., yang Minyak rue dapat dipisahkan menjadi sekitar 150 konstituen, pada tahun 1981. Namun, masalahnya terkait dengan kerapuhan kapiler kaca dan instalasi yang rumit mengurangi pengakuan jenis kolom ini, terlepas dari kualitasnya yang luar biasa. Ini telah berubah sejak kapiler silika leburan yang dapat dilepas menjadi tersedia secara komersial, yang hampir tidak bisa dipecahkan penggunaan normal. Selain itu, dengan teknologi pengaitan silang yang berbeda, masalah yang terkait dengan pelapisan dinding, terutama dengan fase polar, telah diatasi, sehingga semua jenis penting fasa diam yang digunakan dalam GC konvensional telah tersedia secara komersial. Yang paling sering digunakan fase diam untuk analisis minyak esensial telah, dan masih hari ini, fase kutub Carbowax 20M (DB-Wax, Supelcowax-10, HP-20M, Innowax, dll.), 14% cyanopropylphenyl – 86% metil polysiloxane (DB-1701, SPB-1701, HP-1701, OV-1701, dll.), dan fase nonpolar PDMS (DB-1, SPB-1, HP-1 dan HP-1ms, CPSil-5 CB, OV-1, dll.), Dan 5% phenyl methyl polysiloxane (DB-5, SPB-5, HP-5, CPSil-8 CB, OV-5, SE-54, dll.). Selain diameter kolom yang berbeda 0,53, 0,32, 0,25, 0,10, dan 0,05 mm, berbagai ketebalan akhir dapat dibeli. Meningkatkan kolom diameter dan ketebalan fasa diam fase meningkatkan kapasitas sampel dengan mengorbankan pemisahan efisiensi. Namun, kapasitas sampel menjadi penting, terutama dalam analisis jejak dan dengan beberapa teknik ditulis dgn tanda penghubung seperti kromatografi gas-Fourier transform infrared (GC-FTIR), di mana kapasitas sampel yang lebih tinggi diperlukan bila dibandingkan dengan GC-MS. Di sisi lain, itu penerapan kolom bore sempit dengan 100 μm I.D. dan lapisan tipis 0,2 μm telah ditunjukkan menjadi sangat efisien dan jumlah pelat teoritis sekitar 250.000 diterima kapiler 25 m (Lancas et al., 1988). Detektor paling umum di GC adalah FID karena sifatnya sensitivitas tinggi terhadap senyawa organik. TCD yang berlaku universal saat ini hanya digunakan untuk deteksi gas-fed karena sensitivitasnya yang sangat rendah dibandingkan dengan FID, dan tidak dapat digunakan GC kapiler. Senyawa yang mengandung nitrogen dapat secara selektif dideteksi dengan bantuan selektif Nitrogen-fosfor detector (NPD), dan senyawa terklorinasi oleh selektif dan sangat detektor penangkap elektron sensitif (ECD), yang sering digunakan dalam analisis pestisida. Senyawa yang mengandung oksigen telah secara selektif dideteksi dengan alat analisa O-FID khusus bahkan di dalamnya sampel yang sangat kompleks, yang terutama digunakan untuk analisis senyawa beroksigen di bensin, digunakan sebagai agen pencampur bahan bakar (Schneider et al., 1982). Selektivitas oksigen dari FID diperoleh dengan dua reaksi postcolumn on-line: Pertama reaksi retak membentuk karbon monoksida, yang berkurang dalam reaktor kedua menghasilkan jumlah metana yang sama, yang bisa sensitif dideteksi oleh FID. Karena secara total setiap atom oksigen diubah menjadi satu molekul metana, respon FID sebanding dengan jumlah oksigen dalam molekul masing-masing. Aplikasi dari O-FID untuk analisis minyak esensial telah disajikan. Namun, GC konvensional menggunakan kapiler silika terfusi dengan fase stasioner yang berbeda, termasuk kiral fase, dan FID sensitif, hingga kini teknik utama untuk analisis minyak esensial.
5.1.c Kromatografi Kolom Cair
Berbagai jenis LC telah banyak digunakan dalam skala preparatif atau semipreparatif untuk preseparasi minyak atsiri atau untuk isolasi konstituen minyak individu untuk elusidasi struktur dengan metode spektroskopi dan jarang digunakan pada saat itu sebagai alat pemisahan analitik saja, karena GC memainkan peran sentral dalam studi minyak esensial. Pendekatan yang berbeda selain GC dua dimensi, yang telah sering digunakan di masa lalu untuk diatasi puncak yang tumpang tindih dalam satu larikan GC dari minyak atsiri telah dipisahkan dari minyak dengan LC. Metode fraksinasi yang paling umum adalah pemisahan hidrokarbon dari oksigenasiterpenoid menurut Miller menggunakan silika gel sebagai adsorben. Setelah elusi dari komponen nonpolar dari kolom dengan pentana atau heksana, yang mengandung oksigen lebih polar konstituen dielusi dalam rangka meningkatkan polaritas setelah menerapkan lebih banyak dan lebih polar eluen.Fraksinasi yang sangat sederhana dan standar dalam hal kecepatan dan kesederhanaan telah dipublikasikan oleh Kubeczka menggunakan kromatografi kolom kering. Prosedurnya, yang telah terbukti bermanfaat dalam berbagai eksperimen untuk penguraian minyak esensial, memungkinkan preseparasi menjadi lima fraksi meningkatnya polaritas. Preseparasi minyak esensial menjadi oksigen konstituen, hidrokarbon monoterpene, dan hidrokarbon seskuiterpen, yang — bergantung pada komposisi minyak — kadang-kadang penggunaan praktis yang lebih tinggi, dapat berhasil digunakan fase terbalik RP-18 HPLC . HPLC dioperasikan secara semipreparatif skala dengan elusi bertahap dengan metanol - air 82,5: 17,5 (pelarut A) dan metanol murni (pelarut B). Urutan elusi dari minyak yang diteliti adalah sesuai dengan penurunan polaritas komponen dan dalam kelompok hidrokarbon untuk meningkatkan berat molekul. Fraksi 1 terkandung semua mono- dan seskuiterpenoid oksigen, fraksi 2 hidrokarbon monoterpena, dan fraksi 3 — terelusi dengan metanol murni — hidrokarbon seskuiterpena. Alternatif selanjutnya teknik pemisahan yang disebutkan adalah kromatografi fl, awalnya dikembangkan oleh Still, dan yang sering digunakan sebagai bentuk cepat LC preparatif berdasarkan gas atau udara kromatografi kolom pendek tekanan-didorong. Teknik ini, dioptimalkan untuk pemisahan cepat kuantitas biasanya dalam kisaran 0,5-2,0 g menggunakan gel silika yang dikemas dalam kolom yang sesuai. Pemisahan sampel umumnya hanya memakan waktu 5–10 menit dan dapat dilakukan dengan biaya murah peralatan laboratorium. Namun, pengotor dan situs aktif pada silika gel kering ditemukan bertanggung jawab untuk isomerisasi sejumlah konstituen minyak. Setelah penonaktifan silika kering gel dengan menambahkan 5% air, proses isomerisasi dapat dihindari. berbeda pendekatan menggunakan HPLC pada silika gel dan elusi isokratik dengan sistem pelarut terner untuk pemisahan minyak esensial (Scheffer et al., 1976). Berbeda dengan yang disebutkan di atas umum digunakan pra-perlakukan off-line sampel, kopling dua atau lebih kromatografi sistem dalam mode on-line menawarkan keuntungan dari kemudahan otomatisasi dan biasanya lebih singkat waktu analisis. Pemisahan yang disebutkan membutuhkan sekitar 20 jam dan mungkin hanya bernilai kecil dalam aplikasi praktis. HPLC juga telah digunakan untuk memisahkan terpenoid labil termal pada suhu rendah , menunjukkan suhu ketergantungan dari efisiensi pemisahan. Investigasi fraksi minyak esensial dari Cistus ladanifer menggunakan RP-18 HPLC fase terbalik pada suhu kamar dan air asetonitril gradien diterbitkan oleh Strack . Perbandingan kromatogram HPLC yang diperoleh dengan GC run masing-masing menunjukkan pemisahan HPLC yang relatif baik dalam kisaran sesqui- dan diterpenes, sementara monoterpen dipamerkan, seperti yang diharapkan, resolusi yang signifikan yang signifikan oleh GC (Chamblee et al. (1985).
6. KEGUNAAN MINYAK ATSIRI
Saat ini
minyak atsiri sudah digunakan sebagai parfum, kosmetik, antibiotik,
antioksidan, imunostimulan, mengurangi stres, dan terapi bagi penyakit ringan (Sastrohamidjojo,
2004). Komponen minyak atsiri apabila terhirup dapat berinteraksi dengan sistem
syaraf pusat dan langsung bereaksi dengan sistem olfaktori, yang kemudian akan
menstimulasi syaraf pada otak (Buckle, 1999). Minyak atsiri
juga dapat diolah menjadi bahan dasar maupun derivat flavor dan wewangian yang
bersifat alami. Karakter yang spesifik yang tidak dimiliki oleh bahan kimia
sintetik sejenis menjadikan beberapa produk minyak atsiri mempunyai harga
tinggi atau nilai kompetitif, misalnya parfum berbasis absolut bunga, flavor
makanan atau minuman dengan karakter impact compound yang khas seperti minuman
coke atau cola.
Dalam bidang farmasi
dan kesehatan, beberapa komponen utama dalam minyak atsiri seperti linalool,
eugenol, sitronelal, memiliki aktivitas biologis yang khas sehingga digunakan
sebagai bahan antibakteri atau bagian dari formulasi produk obat dan sanitasi.
Obat tetes telinga, minyak telon, minya gosok, dan bahan aromaterapi merupakan
sedikit contoh dari sekian banyak manfaat minyak atsiri (Sastrohamidjojo, 2004).
Minyak
atsiri pada biji kapulaga mengandung terpineol, terpineol asetat, sineol,
borneol, dan kamfer yang berkhasiat mengencerkan dahak, memudahkan pengeluaran
air dari perut, menghangatkan, membersihkan darah, menghilangkan rasa sakit,
mengharumkan, stimulant dan pemberi aroma. Selain itu, kapulaga juga mengandung
zat putih telur, kalsium oksalat dan silisum.
7 RANCANGAN PERCOBAAN
7.1
RANCANGAN PERCOBAAN I
ISOLASI DAN IDENTIFIKASI MINYAK
ATSIRI PADA TUMBUHAN SEMBUKAN (Paederia
foetida L.)
Minyak atsiri merupakan senyawa yang
berasal dari bagian tanaman seperti akar, kulit, batang, daun, buah, biji
maupun dari bunga yang biasanya diperoleh dengan cara penyulingan.
Senyawa-senyawa hidrokarbon yang mempunyai rumus empiris C10H16
dan senyawa-senyawa yang mengandung oksigen dengan rumus empiris C10H16O
dan C10H18O yang dikenal sebagai senyawa terpen merupakan
senyawa yang terkandung dalam minyak atsiri. Agar lebih mengenal minyak atsiri yang terkandung dalam suatu bahan alam
secara lebih mendalam, berikut adalah contoh percobaan isolasi dan identifikasi
minyak atsiri pada tumbuhan sembukan (Paederia foetida L.).Isolasi minyak atsiri dilakukan dengan
menggunakan metode destilasi uap yang selanjutnya dianalisis dengan
kromatografi gas-spektroskopi massa (GC-MS).
Bahan
Siapkan sampel berupa tumbuhan sembukan (Paederia
foetidaL.).Selain itu, siapkan
juga bahan kimia yang diperlukan diantaranya adalah n-heksana p.a, NaCl,
dan akuades.
Alat
Siapkan alat-alat yang diperlukan dalam percobaan
ini diantaranya adalah seperangkat alat destilasi uap, corong pisah,
erlenmeyer, neraca analitik, gelas ukur, botol tempat minyak atsiri, aluminium
foil, cakram kertas saring, cawan petri, mikro pipet, api bunsen, rotari
evaporator, dan seperangkat alat GC-MS.
Prosedur Kerja
Penyiapan sampel
Ambil 3 kg sampel tumbuhan sembukan yang diperoleh.
Cuci bersih tumbuhan sembukan dari kotoran yang menempel kemudian potonglah menjadi
bagian-bagian yang lebih kecil. Pengerjaan menggunakan jaringan segar maka
kondisi tumbuhan sembukan upayakan tetap terjaga kesegarannya.
Isolasi minyak atsiri dengan destilasi
uap
Sebanyak 3 kg tumbuhan sembukan(Paederiafoetida
L.) segar destilasikan secara bertahap sebanyak 3 kali, dan setiap kali
destilasi menggunakan 1 kg tumbuhan sembukan (Paederiafoetida L.) segar.
Tumbuhan sembukan (Paederiafoetida L.) berupa potongan kecil destilasikan
dengan alat destilasi uap. Lengkapi dandang yang digunakan dengan kondensor,
kemudian panaskan.Destilat yang diperoleh merupakan campuran minyak dengan air
yang kemudian dipisahkan dalam corong pisah.
Tambahkan natrium klorida (NaCl) agar minyak yang
teremulsi terpisah dengan sempurna. Tampunglah Fase air dalam erlenmeyer, untuk
dipisahkan lagi karena kemungkinan masih mengandung sedikit minyak yang
teremulsi. Ke dalam fase air ini tambahkan pelarut n-heksan p.a selanjutnya
lakukan pengocokan. Diamkan hingga terbentuk dua lapisan yaitu lapisan atas (n-heksan)
dan lapisan bawah (air). Tampunglah lapisan n-heksan yang diperoleh. Ekstrak
n-heksan tersebut kemudian uapkan menggunakan alat rotari vakum evaporator
hingga diperoleh minyak yang tersisa.
Identifikasi minyak atsiri
Teteskan minyak yang diperoleh sebanyak 1 tetes pada
sepotong kertas saring dan diamkan beberapa menit. Minyak atsiri akan menguap
dengan sempurna tanpa meninggalkan noda transparan.
Analisis dengan kromatografi
gas-spektroskopi massa
Minyak atsiri yang telah diisolasi kemudian dianalisis
menggunakan alat GC-MS untuk mengetahui komponen senyawa golongan kimia
penyusun minyak atsiri tumbuhan sembukan (Paederia foetida L.). Bandingkanspektrum massa yang
diperoleh dari tumbuhan sembukan (Paederiafoetida L.) dengan spektrum
massa dari senyawa pembanding yang diketahui dalam database yang telah
terprogram pada alat GC-MS.
7.2
RANCANGAN PERCOBAAN II
ISOLASI
DAN IDENTIFIKASI KOMPOSISI KIMIA MINYAK ATSIRI DARI BIJI TANAMAN KAPULAGA (Amomum
cardamomum willd)
Kapulaga adalah salah satu
rempah yang dihasilkan oleh Indonesia yang juga merupakan komoditas ekspor.
Kapulaga juga termasuk ke dalam kelompok 9 besar rempah-rempah utama dunia dan
biasanya diperjualbelikan dalam bentuk minyak atsiri maupun buah kering.
Pemanfaatan Kapulaga dalam bentuk minyak atsiri dapat digunakan sebagai bahan
aromatik, mengobati batuk, bau mulut, dan gatal tenggorokan Sedangkan buah
keringnya biasa digunakan sebagai bahan tambahan untuk penyedap masakan, kue,
gula, serta obat-obatan penghilang rasa sakit (Suratman,1997). Biji Kapulaga
mengandung terpineol, terpineol asetat, sineol, borneol, dan kamfer yang
berkhasiat mengencerkan dahak, memudahkan pengeluaran air dari perut,
menghangatkan, membersihkan darah, menghilangkan rasa sakir, mengharumkan,
stimulant dan pemberi aroma. Selain itu, kapulaga juga mengandung zat putih
telur, kalsium oksalat dan silisum (Tambunan, 2017).
Alat dan
Bahan
Ø Alat
Seperangkat alat distilasi
uap, neraca analitis, Evaporator Buchii, Refraktometer ABBE, piknometer, corong
pisah, seperangkat alat GC-MS.
Ø Bahan
Biji kapulaga, air suling,
petroleum eter, Na sulfat anhidrat.
Prosedur
Percobaan
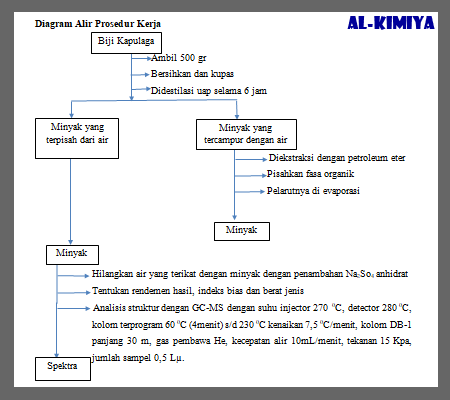
- Bersihkan biji kapulaga dan kupas sebanyak 500 gram
- Lakukan destilasi uap selama 6 jam
- Hitung dari tetesan destilat pertama keluar
- Pisahkan minyak yang terpisah dari air
- Kemudian minyak yang masih tercampur dengan air pisahkan dengan cara ekstraksi menggunakan petroleum eter.
- Pisahkan fasa organiknya, dan lakukan evaporasi terhadap pelarutnya
- Kumpulkan minyak yang diperoleh dalam satu wadah
- Tambakan Na2So4 anhidrat untuk menghilangkan air yang terikut dalam minyak
- Tentukan rendemen hasil, tetapan fisik yakni indeks bias dan berat jenis
- Lakukan analisis struktur dengan menggunakan GC-MS, dengan kondisi suhu injector 270 oC, detector 280 oC, kolom terprogram 60 oC (4 menit) s/d 230 oC kenaikan 7,5 oC/menit, kolom DB-1 panjang 30 m, gas pembawa He, kecepatan alir 10 mL/menit, tekanan 15 Kpa, jumlah sample 0,5 Lm.
GLOSARIUM
- Destilasi atau penyulingan adalah suatu metode pemisahan bahan kimia berdasarkan perbedaan kecepatan atau kemudahan menguap (volatilitas) bahan. Dalam penyulingan, campuran zat dididihkan sehingga menguap, dan uap ini kemudian didinginkan kembali ke dalam bentuk cairan.
- Isolasi adalah proses pengambilan atau pemisahan senyawa bahan alam dengan menggunakan pelarut yang sesuai.Senyawa-senyawa tersebut dapat berupa senyawa metabolit primer dan senyawa metabolit sekunder
- Ekstraksi adalah suatu proses pemisahan suatu zat berdasarkan perbedaan kelarutannya terhadap dua cairan tidak saling larut yang berbeda, biasanya air dan yang lainnya pelarut organik.
SOAL-SOAL
A.
Pilihan
Berganda
1. Biji
kapulaga mengandung minyak atsiri sebagai berikut, kecuali……
a.
borneol c.
sitronelol
b.
sineol d.
terpineol
2. Salah
satu kandungan minyak atsiri pada sereh wangi adalah sitronelal. Sitronelal
dapat ditransformasi menjadi minyak atsiri lain melalui reaksi reduksi. Reduksi
sitronelal akan menghasilkan senyawa…….
a.
geraniol c. terpineol
b.
limonena d.
sitronelol
3. Mengapa
produk minyak atsiri mempunyai harga yang tinggi?
a.
Karena minyak atsiri mengandung mineral
yang tinggi
b.
Karena minyak atsiri memiliki karakter spesifik
yg tdk dimiliki bahan kimia sintetik sejenis
c.
Karena tidak ada diproduksi di Indonesia
d.
Karena memiliki aroma yang khas
4. Sitronelol
apabila direduksi akan menghasilkan senyawa…….
a.
3,7-dimetil oktanol c. geraniol
b.
2,6-dimetil oktanol d. mentol
5. Berikut
ini merupakan beberapa kegunaan minyak atsiri yang lazim, kecuali…….
a.
katalis c.
antioksidan
b.
parfum d.anti
bakteri
6. Berikut
ini merupakan faktor yang menyebabkan berkurangnya rendemen minyak atsiri yang
dihasilkan pada saat pengambilan dengan cara penyulingan/destilasi uap,
kecuali……
a. Pada saat destilasi, suhu pemanasan terlalu
tinggi
b. Sampel yang diambil tidak langsung
didestilasi, sehingga terjadi penguapan minyak atsiri yang menyebabkan
kandungan minyak atsiri pada sampel menjadi berkurang
c. Lamanya proses pengecilan sampel
sehingga terjadinya penguapan minyak atsiri
d. Sampel telah dihaluskan sehingga minyak
atsiri sulit keluar dari sampel
B.
Esai
1. Sereh
wangi umumnya mengandung 3 komponen minya atsiri, yaitu sitronelal, sitronelol,
dan geraniol. Tuliskan struktur senyawa-senyawa tersebut dan gugus fungsi
apakah yang terdapat pada senyawa-senyawa tersebut?
2. Mengapa
pengambilan minyak atsiri pada umumnya dilakuan dengan menggunakan destilasi
uap?
3. Pada
umumnya, destilat minyak atsiri yang dihasilkan dari destilasi uap merupakan
minyak atsiri yang masih bercampur dengan air. Berikan 2 cara yang dapat
dilakukan untuk memisahkan minyak atsiri tersebut dari air agar diperoleh
minyak atsiri yang lebih murni. Berikan penjelasan caranya.
KUNCI
JAWABAN
A.
Pilihan
Berganda
1.
C
2.
D
3.
B
4.
A
5.
A
6.
D
B.
Esai
2.
Pengambilan minyak atsiri pada umumnya
dilakukan dengan menggunakan destilasi uap. Hal ini dikarenakan minyak atsiri
yang memiliki titik didih yang rendah (dibawah 100oC) dan sifatnya
yang mudah rusak pada suhu tinggi. Apabila dilakukan dengan destilasi biasa
(suhu 100oC atau lebih), maka minyak atsiri akan rusak sehingga
rendemen yang dihasilkan akan sedikit atau bahkan tidak ada. Oleh sebab itu,
dilakukan dengan teknik destilasi uap (suhu di bawah 100oC) sehingga
minyak atsiri tidak rusak dan rendemen yang dihasilkan lebih banyak.
3.
Cara I: Menggunakan corong pisah
Campuran
minyak atsiri dengan air dimasukkan ke dalam corong pisah dan didiamkan
beberapa saat hingga terbentuk 2 lapisan. Setelah terbentuk, buang lapisan
bawah (air) dan ambil lapisan atasnya. Lapisan atas merupakan minyak atsiri
yang sudah terpisah dari air.
Cara
II: Destilasi
Campuran
minyak atsiri dengan air didestilasi ulang. Minyak atsiri memiliki titik didih
yang lebih rendah dari air (100oC) sehingga minyak atsiri akan
terlebih dahulu menguap. Namun, suhunya harus tetap dijaga agar minyak atsiri
tidak rusak dan agar air tidak ikut menguap. Setelah mengalami kondensasi,
minyak atsiri akan kembali ke dalam bentuk cair dan akan ditampung ke labu
destilat. Hasil destilasi/destilat merupakan minyak atsiri yang sudah terpisah
dari air.
DAFTAR
PUSTAKA
Agoes, A., (2010), Tanaman Obat Indonesia 3rd ed,
Salemba Medika, Jakarta.
Baser, K.H.C dan
Buchbauer, G., (2010), Handbook of Essential
Oils : Science, Technology, and Applications, CRC
Press Taylor and Francis Group, ISBN : 978-1-4200-6315-8.
Buckle, J., (1999), Use of Aromatherapy
as Complementary Treatment for Chronic Pain, J. Alternative Therapies,
5: 42-51.
Fachriyah, E. dan Sumardi, (2007),
Identifikasi Minyak Atsiri Biji Kapulaga (Amomum
cardamomum), Jurnal Sains dan
Matematika, 15(2):83-87,0854-0675.
Ganjewala, D., (2009), Cymbopogon
Essensial Oils: Chemical Compositions and Bioactivities, International
Journal of Essential Oil Therapeutics, 3: 56-65.
Guenther, E., (1972), Minyak
Atsiri, Jilid IV A, Universitas Indonesia Press, Jakarta.
Ketaren, S., (1986).
Pengantar Teknologi Minyak dan Lemak Pangan, Penerbit Universitas Indonesia,
Jakarta.
Lutony, T, dan Yeyet, R., (2002), Produksi dan
Perdagangan Minyak Atsiri, Penerbit Swadaya, Jakarta.
Muchtaridi, (2015), Penelitian
Pengembangan Minyak Atsiri sebagai Aromaterapi dan Potensinya sebagai Produk
Sediaan Farmasi, J. Tek. Ind. Pert, 17(3), 80-88.
Yuda, P.D.G.A., Bawa, I,G,A,G., dan
Gunawan, I,W,G., (2016)., Isolasi dan Identifikasi Minyak Atsiri Dari Tumbuhan Sembukan(paederia foetida L.) dengan Metode
Kromatografi Gas-Spektroskopi Massa (GC-MS), Jurnal Kimia, ISSN 1907-9850.
Pybus, D., dan Sell, C., (1999), The Chemistry of
Fragrance, 63, 2007, 6671-6712.3.
Sastrohamidjojo, H., (2004), Kimia
Minyak Atsiri, Universitas Gadjah Mada, Yogyakarta.
Suratman, E. dan Djauhariya, (1997), Flasma Nutfah Kapulaga dalam
Buletin Penelitian Tanaman Rempah dan Obat, vol 3, no 1, Balai
Penelitian Tanaman Rempah dan Obat, Semarang.
Tambunan, L., R., (2017), Isolasi dan Identifikasi Komposisi Kimia
Minyak Atsiri dari Biji Tanaman Kapulaga (Amomum Cardamomum Willd), Jurnal
Kimia Riset, 2(1), Politeknik
Meta Industri Cikarang.
Wijesekera, R.O.B., (1973), The Chemical Composition
and Analysis of Citronella Oil, Journal of the National Science Council of
Srilanka, 1, 67-81.
Label: Artikel







0 Komentar:
Posting Komentar
1. Dilarang Spam
2. Dilarang menggunakan kata-kata kasar/tidak sopan
Berlangganan Posting Komentar [Atom]
<< Beranda